131
с раствором и под действием электрического тока. В нем в отличие от гетерогенного катализа
возможно управление химическим процессом при изменении электрического тока. При
фотокатализе химическая реакция стимулируется энергией поглощенного излучения, и она
может происходить на поверхности твердого тела (в том числе и на поверхности электрода) или в
жидком растворе. Процесс с участием ферментов называется ферментативным катализом. Ему
присущи свойства как гетерогенного, так и гомогенного катализа. Ферменты – это большие
белковые структуры, способные удерживать молекулы реагента в ждущем состоянии до начала
реакции. Фермент, кроме того, собирает подходящее химическое окружение, катализирующее
нужную реакцию по прибытии партнера.
Гетерогенный катализ
Одна из важных задач гетерогенного катализа – увеличение эффективной поверхности
катализатора. Удельная поверхность катализаторов, применяемых в промышленности, составляют
около 150 м²/г. Некоторые катализаторы на основе активированного угля или молекулярных сит
имеют удельную поверхность до 1000 м²/г. Кроме большой активной поверхности, катализаторы
должны иметь небольшую массу, высокую прочность и обтекаемость. Совокупностью таких
свойств обладают перспективные катализаторы – искусственные цеолиты (молекулярные сита) и
пористая керамика.
Гетерогенный катализ известен давно – еще со времен шведского химика И.Я. Берцелиуса
(1799–1848), но только недавно – примерно 20 лет назад – уникальные методы и приборы открыли
путь для экспериментального исследования химических явлений на поверхности. В результате
гетерогенного катализа получается из элементных азота и водорода аммиак NH3
– важнейший
компонент удобрений. При повышенной температуре N2 и Н2 могут реагировать с образованием
NH3 на совершенных кристаллах железного катализатора. Грань кристалла железа (111) примерно
в 430 раз активнее, чем грань (110) и в 13 раз активнее, чем грань (100). Синтез аммиака – один из
первых каталитических процессов, внедренный в крупное промышленное производство. Обычно
катализатором для такого синтеза служат мелкие частицы железа – тонко-дисперсное железо,
осажденное на оксиде алюминия с добавкой оксида калия. Синтез происходит при 500° С. В
последнее время проводится поиск катализатора, который позволил бы снизить температуру
синтеза.
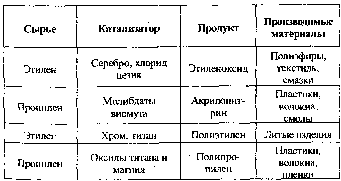
К настоящему времени освоены многие новые каталитические процессы для промышленного
производства ценных продуктов (табл. 6.1).
Таблица 6.1.
Современные экспериментальные средства позволяют проследить за поведением атомов на
поверхности твердого катализатора. Поверхностные атомы обладают способностью образовывать
химические связи и влиять на химические свойства молекул. Поэтому поведение реагентов на
поверхности твердого катализатора может резко отличаться от поведения тех же молекул в
растворе или газовой фазе.
Одно из перспективных направлений повышения эффективности катализа заключается в
разработке молекулярных cит
– природных или синтетических материалов, содержащих
алюминий, кремний и кислород (алюмосиликаты) и включающих мельчайшие пустоты и каналы,
образующие пористую структуру. Попавшие внутрь пустот и каналов молекулы вступают в
химическую реакцию, которая при обычных условиях возможна только при высокой температуре.
Форма и размер внутренних полостей не только влияют на селекцию реагентов, но и
ограничивают размер частиц конечного продукта, т.е. молекулярные сита – селективные

